Czy mikrobiom jelitowy ma wpływ na nasze zdrowie i alergie?
Alergie pokarmowe stały się dziś powszechne. Uważa się, że na ten wzrost wpływa wiele czynników, m.in. większa liczba cesarskich cięć i nadużywanie antybiotyków, które mogą likwidować ochronne bakterie. Cathryn Nagler z Uniwersytetu w Chicago zastanawiała się, czy wzrost liczby przypadków dziecięcych alergii pokarmowych można powiązać z mieszanką mikrobową w jelitach.
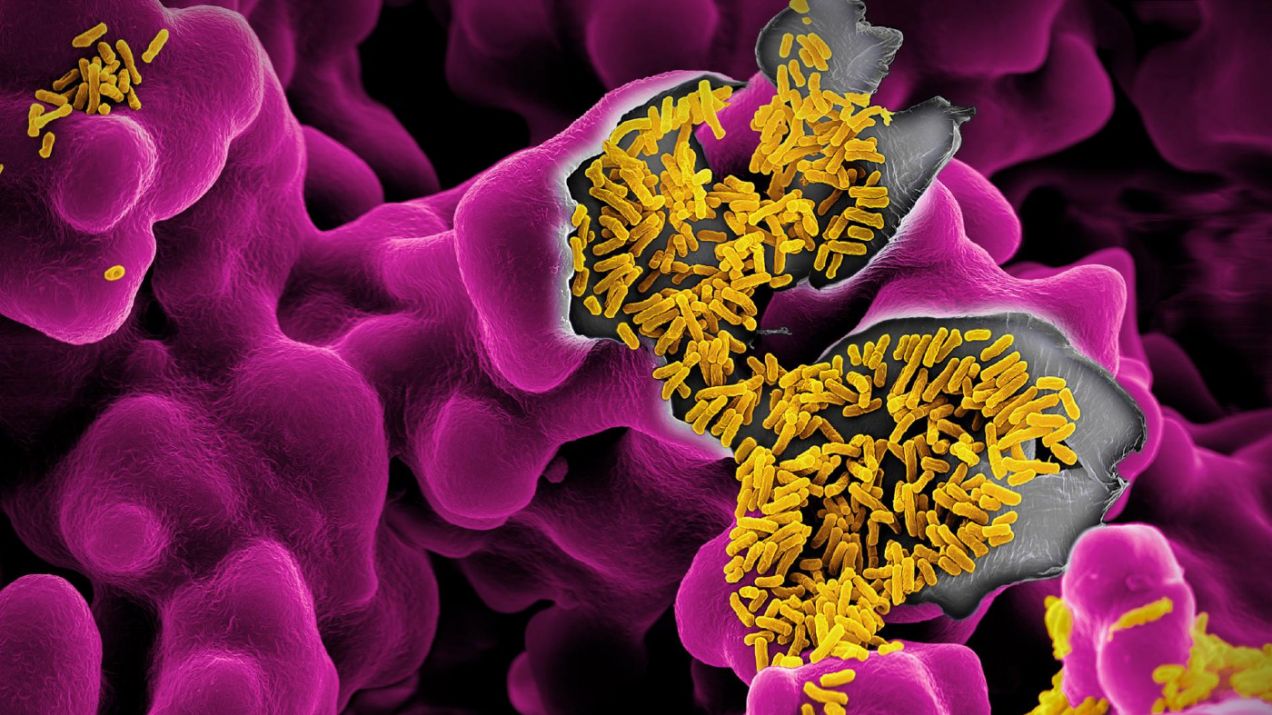
W zeszłym roku badacze opublikowali wyniki badania ośmiorga sześciomiesięcznych niemowląt, z których połowa była uczulona na krowie mleko, a połowa nie. Odkryli, że mikrobiomy obu grup są całkiem odmienne. Zdrowe niemowlęta miały bakterie, których można się spodziewać u typowo rozwijających się dzieci w ich wieku. Natomiast bakterie dzieci z alergią na krowie mleko bardziej przypominały mikrobiom dorosłych. U alergicznych dzieci przejście od niemowlęcego do dorosłego mikrobiomu, normalnie powolne, odbyło się „z prędkością światła”, jak mówi Nagler.
Wykorzystując próbki stolca, badacze przeszczepili bakterie jelitowe badanych dzieci sterylnym myszom. Takim, które wydobyto na świat przez cesarskie cięcie i hodowano w sterylnych warunkach, żeby nie miały żadnych mikrobów. Myszy, które otrzymały przeszczepy od zdrowych niemowląt, uzyskały ochronne bakterie zapobiegające alergii na krowie mleko. Natomiast przeszczepy od dzieci uczulonych nie zapewniały takiej ochrony i te myszy przejawiały reakcję alergiczną. Dalsza analiza wykazała, że w ochronie pierwszej grupy myszy, najważniejszą rolę wydaje się odgrywać zwłaszcza jeden gatunek bakterii, wyjątkowy dla ludzkich niemowląt – Anaerostipes caccae z klasy Clostridia.
Nagler, która jest prezesem i współzałożycielką chicagowskiego startupu farmaceutycznego ClostraBio, liczy na to, że uda się jej sprawdzić terapeutyczny potencjał tych bakterii u laboratoryjnych myszy – a w końcu także pacjentów z uczuleniami. Pierwszym wyzwaniem było znalezienie w jelitach miejsca, w którym te dobroczynne mikroby mogłyby wylądować. Nawet w niezdrowym mikrobiomie, jak mówi Nagler, wszystkie nisze są już wypełnione – żeby Clostridia mogły wejść, coś innego musi wyjść.
Dlatego firma ClostraBio opracowała lek, który uwalnia niszę w mikrobiomie. Nagler podawała myszom ten środek, a następnie faszerowała je różnorakimi drobnoustrojami Clostridia wraz z błonnikiem pokarmowym, który sprzyja ich rozwojowi. Ma nadzieję, że w ciągu dwóch lat rozpocznie testy kliniczne na ludziach. Ostatecznym celem jest podawanie tych środków dzieciom z alergiami pokarmowymi. Mikroby jelitowe można też powiązać z innymi chorobami dziecięcymi, takimi jak cukrzyca typu 1.
W Australii naukowcy pobrali próbki stolca od 93 dzieci, w których rodzinach występowała ta postać cukrzycy. Stwierdzili, że te, u których rozwinęła się choroba, miały wyższe poziomy enterowirusa A. Jeden z badaczy biorących udział w tym studium, W. Ian Lipkin z Columbia University Mailman School of Public Health, ostrzega naukowców przed pośpiesznym wyjaśnianiem przyczyn choroby – cukrzycy bądź każdej innej – samymi tylko różnicami w mikrobiomie. Na razie wiadomo tylko tyle, że pewne mikroby mają związek z pewnymi stanami chorobowymi.
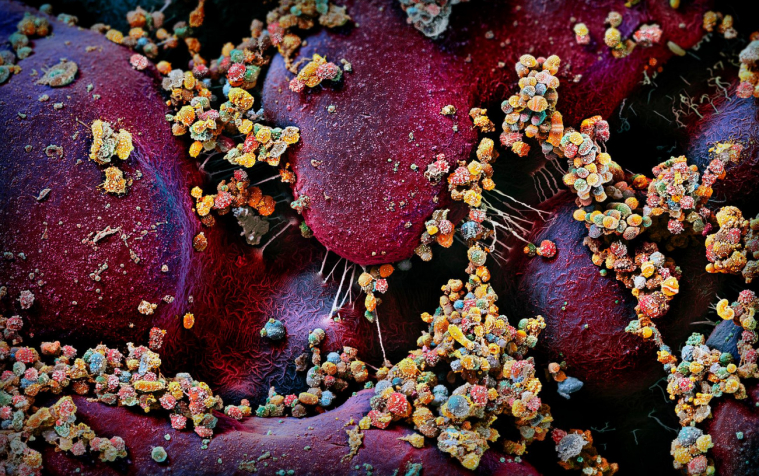
Wilgotne usta są bogate w mikroby. Kobieta przycisnęła usta do szalki Petriego, aby pozwolić swojemu mikrobiomowi rosnąć i rosnąć. Kilka dni później rozkwitła kolonia. / Photograph by Martin Oeggerli
Mimo tego zastrzeżenia Lipkina, ekscytują się możliwości nauki o mikrobiomie. Spodziewa się, że za 5–10 lat badacze zrozumieją mechanizmy wpływu mikrobiomu na organizm. Co pozwoli rozpocząć próby kliniczne na ludziach, by zademonstrować, jakie skutki zdrowotne przynoszą jego zmiany.
Jak naukowcy chcą zwalczyć mikrobiom trądzikowy?
Duża część nastolatków w krajach rozwiniętych ma skłonność do wyprysków. W ich przypadku rzeczywiście wydaje się istnieć coś takiego jak „trądzikowy mikrobiom”. Skóra wielu nastolatków jest szczególnie gościnna dla dwóch szczepów Cutibacterium acnes blisko powiązanych z trądzikiem. Większość szczepów tych bakterii, choć mają w nazwie słowo acnes (trądzik), jest nieszkodliwa albo pomocna, bo trzymają na dystans patogenne mikroby.
Prawdę mówiąc, C. acnes jest dominującym składnikiem normalnego mikrobiomu twarzy i szyi. Ale posiadanie łajdackiego szczepu C. acnes może być problemem. To jeden z elementów potrzebnych do rozwoju trądziku, twierdzi Amanda Nelson, dermatolożka z Penn State University College of Medicine. Inne to łój (tłuszcz wytwarzany przez gruczoły łojowe w celu nawilżania skóry), będący dla C. acnes pożywką, zatkane mieszki włosowe i reakcja zapalna. Te cztery czynniki działają wspólnie.
Trądzikowy mikrobiom był przedmiotem badania prowadzonego przez Washington University School of Medicine w St. Louis. W ramach którego naukowcy stwierdzili, że jedyny lek na trądzik prowadzący do długotrwałej remisji – izotretynoina, działa po części poprzez zmianę skórnego mikrobiomu ograniczającą liczbę bakterii C. acnes przy zwiększaniu jego ogólnej różnorodności. W tym zdrowszym, bardziej zróżnicowanym środowisku niedobrym szczepom C. acnes trudniej jest się zadomowić. Teraz, gdy badacze już wiedzą, że izotretynoina działa poprzez zmienianie trądzikowego mikrobiomu, mogą próbować stworzyć mikrobowe leki. Te alternatywne środki mogą obejmować coś, co naukowcy z Washington University nazywają „prebiotycznymi nawozami” i „pestycydami”.
Te pierwsze to mikroby, które tworzą warunki umożliwiające rozkwit zdrowego mikrobiomu skórnego. Te drugie działają na wybrane szczepy – likwidują szkodliwe szczepy C. acnes, a pozostawiają w spokoju te dobroczynne. W skład mieszanki mogą też wchodzić probiotyki, suplementy doustne lub stosowane miejscowo, zawierające bezpośrednie dawki dobroczynnych szczepów Cutibacterium.