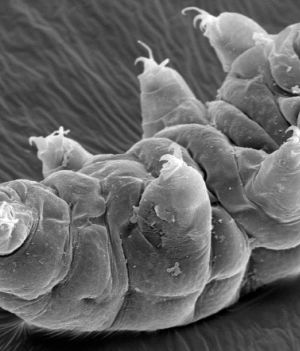
– W tym przypadku trzeba będzie dokonać modyfikacji, która sprawi, że owad stanie się bezpłodny – tłumaczy. – No bo jaki sens miałoby tworzenie komara, który wprawdzie nie przenosi wirusa zika, ale nadal może zarażać dengą i innymi chorobami?
W celu zwalczenia dengi James z zespołem opracowali taki pakiet CRISPR, który po prostu wycina naturalny gen i zastępuje go wersją, która u potomstwa wywoła bezpłodność. Jeśli wypuści się na swobodę wystarczającą ilość takich zmanipulowanych komarów, aby krzyżowały się z dzikimi, to w ciągu paru pokoleń (a jedno pokolenie trwa zaledwie dwa, trzy tygodnie) zmieniony gen rozprzestrzeni się na cały gatunek.
James dobrze zdaje sobie sprawę z tego, że wypuszczenie na swobodę organizmów z mutacjami, które mają zdolność szybkiego szerzenia się w naturalnych populacjach, może mieć nieprzewidziane i nieodwracalne skutki. – Z pewnością istnieje ryzyko związane z wypuszczaniem owadów poddanych inżynierii genetycznej – przyznaje – Ale jestem przekonany, że skutki zaniechania są znacznie groźniejsze.
Z górą 40 lat minęło od czasu, gdy naukowcy po raz pierwszy odkryli metodę wycinania łańcuchów nukleotydów z materiału genetycznego jednego gatunku organizmów i wprowadzania go do genomu innego gatunku w celu przeniesienia pożądanych cech. Biolodzy molekularni byli pod wrażeniem możliwości badawczych i praktycznych, jakie dawała ta procedura zwana rekombinacją genetyczną. Od początku jednak zdawali sobie sprawę, że jeśli potrafią przenieść DNA z jednego gatunku do drugiego, to mogą również, nieumyślnie, przenieść wirusy i inne czynniki zakaźne. To mogło wywołać jakieś nieprzewidziane choroby, na które nie byłoby naturalnej odporności, nie byłoby także leków.
W 1975 r. w centrum konferencyjnym Asilomar w Kalifornii zgromadzili się biolodzy molekularni z całego świata, aby dyskutować o problemach, jakie wiążą się z inżynierią genetyczną. Na spotkaniu wyłoniono grupę, która uzgodniła zestaw środków ostrożności stosowanych w tego rodzaju badaniach; wprowadzono też trzy klasy zabezpieczeń laboratoriów, zależne od tego, jakiego rodzaju eksperymenty są prowadzone. Przyjęte wtedy środki ostrożności okazały się skuteczne, zaś korzyści z badań – ogromne. Inżynieria genetyczna wpłynęła na poprawę życia milionów ludzi. I tak na przykład cukrzyków leczy się insuliną produkowaną metodami inżynierii genetycznej – ludzki gen odpowiedzialny za wytwarzanie insuliny wprowadzono do organizmów bakterii i te transgeniczne bakterie hoduje się na masową skalę, aby wytwarzały hormon. Modyfikowane genetycznie rośliny uprawne, które dają wyższe plony i są odporne na szkodniki, zajmują coraz więcej miejsca w rolnictwie światowym.
Ale choć leki uzyskane za pomocą inżynierii genetycznej zyskały powszechną akceptację, to żywność otrzymywana podobnymi metodami – nie. I to pomimo setek badań, które wykazały ponad wszelką wątpliwość, że jest równie bezpieczna jak każda inna. CRISPR może się okazać sposobem na wyjście z tego naukowo-społecznego impasu. Od początków inżynierii genetycznej takie określenia jak „transgeniczny” czy „GMO” dotyczyły praktyki łączenia w laboratorium DNA pochodzącego od gatunków zwierząt lub roślin, które nie miały możliwości krzyżowania się w naturze. Naukowcy mają nadzieję, że wykorzystanie CRISPR do wprowadzania zmian w DNA nie wywoła takiego sprzeciwu. Metoda ta pozwala zmieniać konkretne geny bez konieczności wprowadzania DNA pochodzącego od innych gatunków. I tak na przykład „złoty ryż”, odmiana ryżu siewnego uzyskana metodami inżynierii genetycznej, zawiera geny umożliwiające syntezę prowitaminy
A, do czego niezdolny jest ryż naturalny. Rok w rok pół miliona dzieci w krajach Trzeciego Świata ślepnie z powodu braku witaminy A. „Złoty ryż” uchroniłby je przed takim losem, ale przeciwnicy GMO uniemożliwili dokończenie badań i wprowadzenie tego ryżu do uprawy.