Każdy, kto rzuci okiem na jego gabinet, bez trudu zgadnie, czym Anthony James się zajmuje. Pełno tam bowiem rysunków, zdjęć i książek o komarach.
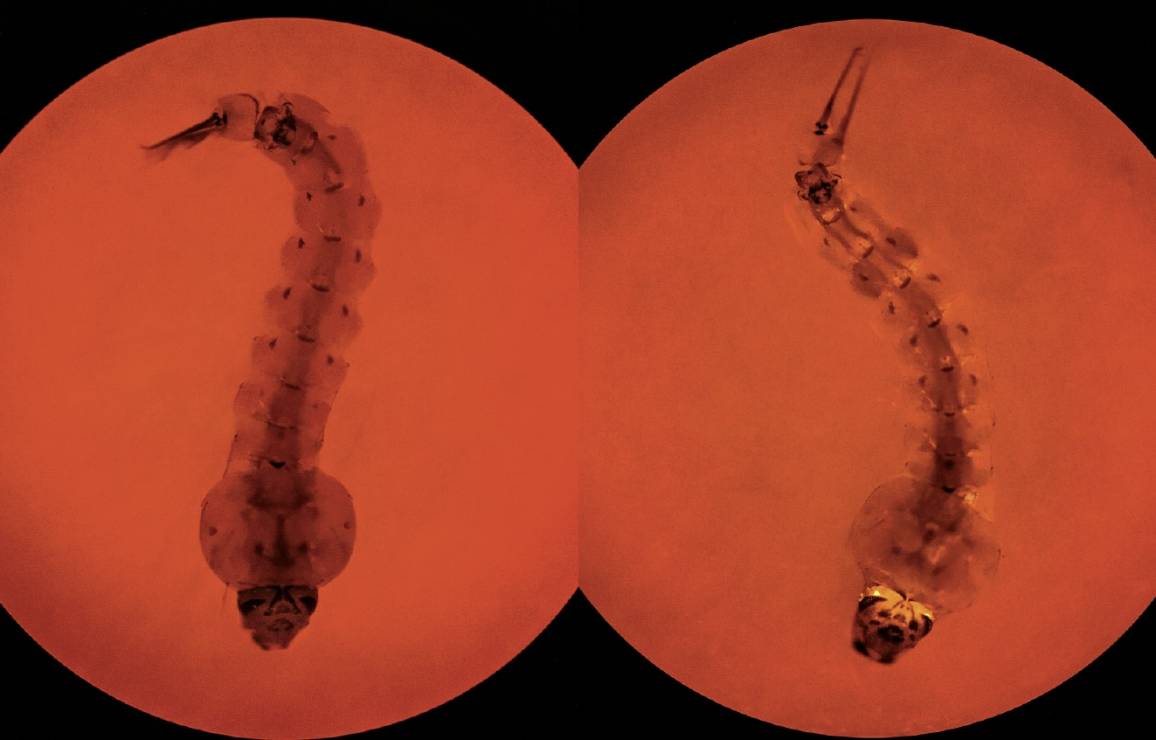
Nad biurkiem wisi plakat z portretem Aedes aegypti (komar egipski) w kolejnych stadiach rozwojowych: jajo, larwa, poczwarka, owad dorosły (imago). Rysunki są tak wielkie, że na ich widok zblednie nawet miłośnik potworów z Parku jurajskiego. Samochód Jamesa ma spersonalizowaną tablicę rejestracyjną, na której widnieje tylko jedno słowo: AEDES. – Obsesję na punkcie komarów mam od 30 lat – przyznaje James. Jest genetykiem molekularnym, pracuje na Uniwersytecie Kalifornijskim w Irvine.
Nauka zna mniej więcej 3,5 tys. gatunków komarów, ale James skupił się zaledwie na kilku. Z tym że każdy z tych gatunków należy do najbardziej śmiercionośnych istot na Ziemi. Taki na przykład Anopheles gambiae przenosi pasożyta wywołującego malarię (zimnicę), chorobę, która uśmierca co roku setki tysięcy ludzi. Najwięcej uwagi poświęcił jednak James rodzajowi Aedes. Historycy sądzą, że te właśnie komary dotarły do Nowego Świata w XVII w. pod pokładami statków niewolniczych i przyniosły ze sobą żółtą febrę, która zgładziła miliony ludzi. Ten gatunek roznosi też wirusa dengi – choroby, na którą zapada ok. 400 mln ludzi rocznie – a także stanowiące coraz większe zagrożenie epidemiologiczne wirusy czikungunia, Zachodniego Nilu i zika.
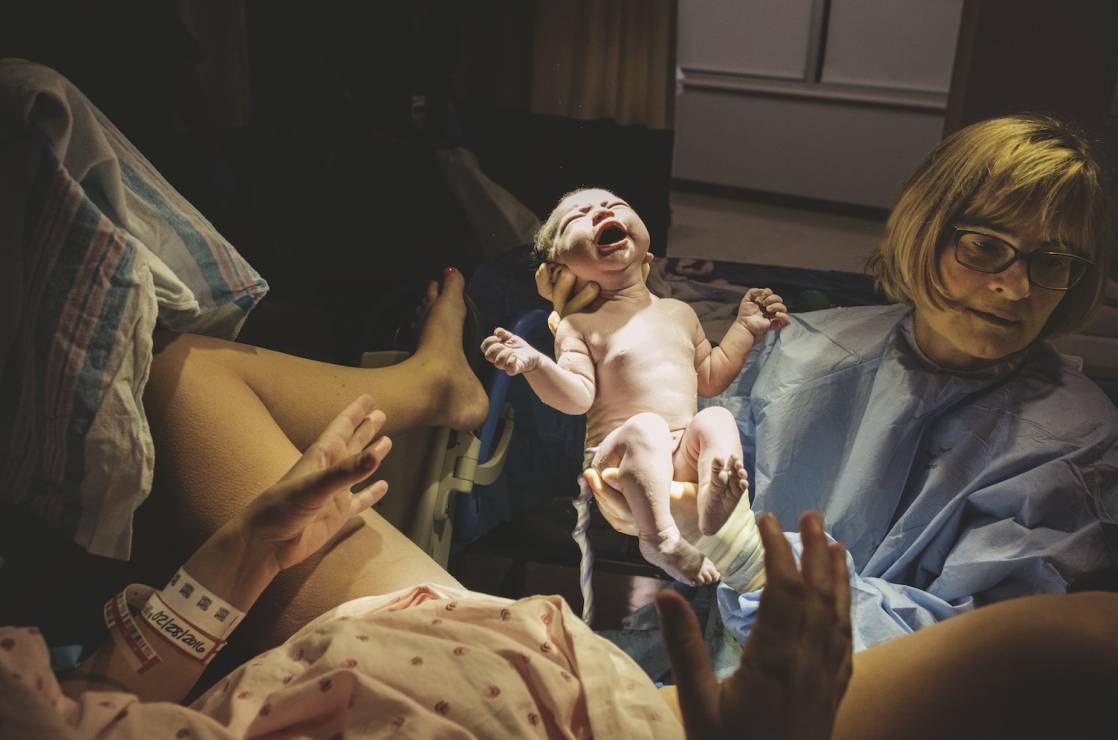
W Brazylii w ubiegłym roku wybuchła epidemia zakażeń wirusem zika. Powoduje on rozmaite zaburzenia neurologiczne, w tym rzadką wadę rozwojową zwaną małogłowiem, w wyniku której rodzą się dzieci z nienaturalnie małą czaszką i niedorozwiniętym mózgiem.
Celem pracy Jamesa i jego zespołu jest opracowanie sposobu manipulacji genami komara, tak aby owad nie mógł przenosić patogenów. Do niedawna taka możliwość wydawała się raczej teoretyczna, a w każdym razie niezwykle odległa. Okazało się jednak, że dzięki połączeniu nowoczesnego narzędzia inżynierii genetycznej o nazwie CRISPR-Cas9 z pewnym naturalnym mechanizmem zwanym „napędem genowym” teoria szybko staje się rzeczywistością.
CRISPR to narzędzie, które daje nam zupełnie nowe możliwości. Dzięki niemu naukowcy mogą „redagować” DNA, czyli modyfikować, wycinać i przestawiać odcinki DNA niemal dowolnego żywego organizmu – w tym także człowieka. Przez ostatnie trzy lata narzędzie to zrewolucjonizowało inżynierię genetyczną. Prowadząc badania na transgenicznych zwierzętach laboratoryjnych, tzw. modelach zwierzęcych, naukowcy wykorzystują CRISPR do naprawiania poważnych wad dziedzicznych, jak np. mutacji odpowiedzialnych za dystrofię mięśniową i mukowiscydozę. Ostatnio kilka zespołów posłużyło się metodą CRISPR do wyeliminowania wirusa HIV z DNA komórek ludzkich. Wyniki były tylko częściowo zadowalające, ale wielu naukowców żywi przekonanie, że to narzędzie pozwoli na opracowanie leku, który raz na zawsze zwalczy AIDS.
W ramach doświadczeń badacze używali też CRISPR do usuwania wirusów świń, które uniemożliwiają przeszczepianie ich narządów ludziom. Ekolodzy z kolei wiążą z tym narzędziem nadzieję na ratowanie gatunków zagrożonych wyginięciem. A biolodzy zajmujący się roślinami uprawnymi próbują tą metodą zlikwidować geny odpowiedzialne za przyciąganie szkodników. Jeśli im się powiedzie, będzie można ograniczyć zużycie chemicznych pestycydów.
Nie było chyba w ostatnim stuleciu odkrycia, które niosłoby więcej obietnic – ale też trudnych problemów etycznych. Załóżmy prowokacyjnie, że CRISPR zostałoby wykorzystane do redagowania DNA w komórkach linii germinalnej zarodka ludzkiego (te, których materiał genetyczny jest przekazywany do następnych pokoleń; komórki prekursorowe komórek rozrodczych) w celu skorygowania jakiejś wady genetycznej lub też po to, aby wzmocnić jakąś cechę pożądaną. Taka zmiana byłaby przekazywana dzieciom, wnukom itd. Wszystkie konsekwencje tak głębokiej ingerencji są trudne do przewidzenia.
– To jest niezwykłe narzędzie, ma bardzo wiele wspaniałych zastosowań. Ale gdybyśmy mieli je użyć do modyfikacji komórek linii germinalnej, musielibyśmy mieć do tego naprawdę bardzo ważny powód – zauważa Eric Lander, były szef projektu poznania ludzkiego genomu (Human Genome Project) i dyrektor Instytutu im. Broadów (ufundowany przez małżeństwo Eli i Edythe Broadów międzyuczelniany instytut badawczy, którego partnerami są Uniwersytet Harvarda i Massachusetts Institute of Technology, zajmujący się badaniami biomedycznymi i genetycznymi). Musiałoby też istnieć przyzwolenie społeczne na takie działania, bo bez powszechnej zgody nie jest to możliwe. To nie w gestii naukowców leży odpowiedź na to pytanie. Zresztą prawdę mówiąc, nie bardzo wiem, w czyjej.
Narzędzie CRISPR-Cas9 ma dwa składniki. Pierwszy to enzym Cas9, który działa jak komórkowy skalpel do przecinania DNA (w warunkach naturalnych używają go bakterie do wycina-
nia i unieszkodliwiania materiału genetycznego wirusów, które je atakują). Drugi składnik to specjalne „przewodnikowe” RNA, gRNA (guide RNA), coś w rodzaju pilota, który prowadzi ten skalpel do konkretnych nukleotydów (liter DNA), które mają być przecięte.
Precyzja tego przewodnika jest niesamowita. Naukowcy mogą wysłać zsyntetyzowany fragment DNA w dowolne miejsce genomu i trafić w nie idealnie, choć genom składa się przecież
z miliardów nukleotydów. Po dotarciu do celu enzym Cas9 wycina niepożądaną sekwencję DNA. Potem dziura po wycięciu jest łatana łańcuchem nukleotydów, którą dostarczył pakiet CRISPR.
Amerykańska służba epidemiologiczno-profilaktyczna Centers for Disease Control and Prevention ocenia na podstawie rozprzestrzeniania się dotychczasowych epidemii chorób przenoszonych przez komary, że na Portoryko, nim wygaśnie epidemia zakażeń wirusem zika, zarażona będzie co najmniej jedna czwarta z 3,5-milionowej ludności wyspy. A to oznacza, że wśród zakażonych będą tysiące kobiet w ciąży. Gdyby chcieć dotychczasowymi metodami zwalczyć wirusa zika, trzeba by całą wyspę zalać środkami owadobójczymi. James i jego koledzy są zdania, że znacznie lepszy sposób polegałby na tym, by poddać modyfikacji geny komarów za pomocą CRISPR, a następnie, wykorzystując mechanizm napędu genetycznego, sprawić, by zmiany te rozpowszechniły się w populacji.
Napęd genetyczny pozwala przezwyciężyć tradycyjne reguły dziedziczenia. U każdego rozmnażającego się płciowo zwierzęcia potomstwo otrzymuje po jednej kopii genu od matki
i od ojca. Niektóre geny są jednak „samolubne”: ewolucja obdarzyła je większą niż 50 proc. szansą na to, że znajdą się u potomstwa. Teoretycznie jest możliwe połączenie narzędzia CRISPR
z napędem genowym w celu modyfikacji kodu genetycznego jakiegoś zwierzęcia w ten sposób, że połączy się pożądaną sekwencję DNA z takim faworyzowanym genem, a następnie wypuści takie zmodyfikowane zwierzę na swobodę, by w sposób naturalny rozmnażało się płciowo z dzikimi, występującymi w naturze partnerami. Współdziałanie obu narzędzi może wprowadzić niemal każdą cechę dziedziczną do populacji niejako na siłę.
W 2015 r. James ogłosił drukiem w czasopiśmie naukowym Proceedings of the National Academy of Sciences wyniki swojego badania nad wykorzystaniem CRISPR do modyfikacji materiału genetycznego komarów z rodzaju Anopheles w taki sposób, by stały się niezdolne do przenoszenia zarazków zimnicy.
– Dodaliśmy niewielki pakiet genów, który sprawia, że komary działają zupełnie tak jak zwykle. Z jedną małą zmianą – wyjaśnia James. Ta zmiana uniemożliwia przenoszenie śmiercionośnego pasożyta. – Przez dziesiątki lat mozoliłem się w cieniu zainteresowania. Ale to się zmieniło, teraz mój telefon się urywa – cieszy się, pokazując mi stos karteczek z zapisanymi kontaktami.
Walka z komarem egipskim, który przenosi wiele różnych patogenów, będzie wymagała nieco innego podejścia. – W tym przypadku trzeba będzie dokonać modyfikacji, która sprawi, że owad stanie się bezpłodny – tłumaczy. – No bo jaki sens miałoby tworzenie komara, który wprawdzie nie przenosi wirusa zika, ale nadal może zarażać dengą i innymi chorobami?
W celu zwalczenia dengi James z zespołem opracowali taki pakiet CRISPR, który po prostu wycina naturalny gen i zastępuje go wersją, która u potomstwa wywoła bezpłodność. Jeśli wypuści się na swobodę wystarczającą ilość takich zmanipulowanych komarów, aby krzyżowały się z dzikimi, to w ciągu paru pokoleń (a jedno pokolenie trwa zaledwie dwa, trzy tygodnie) zmieniony gen rozprzestrzeni się na cały gatunek.
James dobrze zdaje sobie sprawę z tego, że wypuszczenie na swobodę organizmów z mutacjami, które mają zdolność szybkiego szerzenia się w naturalnych populacjach, może mieć nieprzewidziane i nieodwracalne skutki. – Z pewnością istnieje ryzyko związane z wypuszczaniem owadów poddanych inżynierii genetycznej – przyznaje. – Ale jestem przekonany, że skutki zaniechania są znacznie groźniejsze.
Z górą 40 lat minęło od czasu, gdy naukowcy po raz pierwszy odkryli metodę wycinania łańcuchów nukleotydów z materiału genetycznego jednego gatunku organizmów i wprowadzania go do genomu innego gatunku w celu przeniesienia pożądanych cech. Biolodzy molekularni byli pod wrażeniem możliwości badawczych i praktycznych, jakie dawała ta procedura zwana rekombinacją genetyczną. Od początku jednak zdawali sobie sprawę, że jeśli potrafią przenieść DNA z jednego gatunku do drugiego, to mogą również, nieumyślnie, przenieść wirusy i inne czynniki zakaźne. To mogło wywołać jakieś nieprzewidziane choroby, na które nie byłoby naturalnej odporności, nie byłoby także leków.
W 1975 r. w centrum konferencyjnym Asilomar w Kalifornii zgromadzili się biolodzy molekularni z całego świata, aby dyskutować o problemach, jakie wiążą się z inżynierią genetyczną. Na spotkaniu wyłoniono grupę, która uzgodniła zestaw środków ostrożności stosowanych w tego rodzaju badaniach; wprowadzono też trzy klasy zabezpieczeń laboratoriów, zależne od tego, jakiego rodzaju eksperymenty są prowadzone.
Przyjęte wtedy środki ostrożności okazały się skuteczne, zaś korzyści z badań – ogromne. Inżynieria genetyczna wpłynęła na poprawę życia milionów ludzi. I tak na przykład cukrzyków leczy się insuliną produkowaną metodami inżynierii genetycznej – ludzki gen odpowiedzialny za wytwarzanie insuliny wprowadzono do organizmów bakterii i te transgeniczne bakterie hoduje się na masową skalę, aby wytwarzały hormon. Modyfikowane genetycznie rośliny uprawne, które dają wyższe plony i są odporne na szkodniki, zajmują coraz więcej miejsca w rolnictwie światowym.
Ale choć leki uzyskane za pomocą inżynierii genetycznej zyskały powszechną akceptację, to żywność otrzymywana podobnymi metodami – nie. I to pomimo setek badań, które wykazały ponad wszelką wątpliwość, że jest równie bezpieczna jak każda inna. CRISPR może się okazać sposobem na wyjście z tego naukowo-społecznego impasu. Od początków inżynierii genetycznej takie określenia jak „transgeniczny” czy „GMO” dotyczyły praktyki łączenia w laboratorium DNA pochodzącego od gatunków zwierząt lub roślin, które nie miały możliwości krzyżowania się w naturze. Naukowcy mają nadzieję, że wykorzystanie CRISPR do wprowadzania zmian w DNA nie wywoła takiego sprzeciwu. Metoda ta pozwala zmieniać konkretne geny bez konieczności wprowadzania DNA pochodzącego od innych gatunków. I tak na przykład „złoty ryż”, odmiana ryżu siewnego uzyskana metodami inżynierii genetycznej, zawiera geny umożliwiające syntezę prowitaminy A, do czego niezdolny jest ryż naturalny. Rok w rok pół miliona dzieci w krajach Trzeciego Świata ślepnie z powodu braku witaminy A. „Złoty ryż” uchroniłby je przed takim losem, ale przeciwnicy GMO uniemożliwili dokończenie badań i wprowadzenie tego ryżu do uprawy. Korzystając z CRISPR, naukowcy niemal na pewno mogliby osiągnąć ten sam efekt, zmieniając po prostu istniejące geny ryżu.
Naukowcy japońscy wykorzystali CRISPR do przedłużania życia pomidorów poprzez wyłączenie genów sterujących dojrzewaniem. Chińczycy – Caixia Gao i jej zespół z Akademii Nauk w Pekinie – uzyskali odmianę pszenicy odporną na mączniaka prawdziwego zbóż. Dokonali tego, wycinając trzy kopie jednego z genów pszenicy.
Rolnicy zmieniali pod swoim kątem geny poszczególnych gatunków roślin uprawnych lub zwierząt hodowlanych od tysiącleci, stosując do tego metodę doboru i krzyżowania. CRISPR to po prostu precyzyjniejsza metoda tego samego. W niektórych państwach, np. w Niemczech, Szwecji i Argentynie, instytucje odpowiedzialne za kontrolę żywności rozróżniają GMO i organizmy z genomem redagowanym takimi narzędziami jak CRISPR.
Możliwości, jakie CRISPR otwiera przed medycyną, są trudne do przecenienia. Już dziś nowa metoda przekształciła badania nad nowotworami – dzięki niej łatwiej jest uzyskiwać komórki nowotworowe w laboratorium i testować na nich różne leki, sprawdzając, czy hamują ich rozmnażanie się. Niedługo być może lekarze będą mogli korzystać z CRISPR bezpośrednio do leczenia niektórych chorób.
Materiał genetyczny komórek macierzystych pobranych od osób cierpiących np. na hemofilię będzie można poza organizmem redagować w celu skorygowania wady genetycznej, będącej przyczyną choroby, a następnie takie naprawione komórki wszczepić pacjentowi, by rozmnożyły się w jego krwiobiegu. W ciągu najbliższych dwóch lat będziemy prawdopodobnie świadkami jeszcze radykalniejszego postępu w medycynie.
Od lat naukowcy szukają sposobów, które pozwolą użyć do przeszczepu narządów zwierzęcych. Najlepszym kandydatem na dawcę jest świnia domowa, głównie dlatego, że narządy tego ssaka są mniej więcej tej samej wielkości co nasze. Ale genom świni roi się od tzw. wirusów endogennych (PERV). Nie dość, że są podobne do wirusa wywołującego AIDS, to jeszcze zdolne są do zakażania komórek ludzkich. Nikt nie wyda zezwolenia na transplantację narządu zakażonego wirusami. I jak dotąd nikt nie wiedział, jak pozbyć się ze świni świńskich retrowirusów.
Dziś, dzięki metodzie CRISPR użytej do redagowania genomu świńskich narządów, naukowcy są na najlepszej drodze do rozwiązania problemu. Zespół pod kierunkiem prof. George’a Churcha
z wydziału medycyny przy Uniwersytetu Harvarda i MIT zdołał usunąć wszystkie wystąpienia genów PERV (w sumie 62) z komórki świńskiej nerki. W ramach eksperymentu naukowcy pomieszali redagowane świńskie komórki z ludzkimi. Ani jedna komórka ludzka nie uległa zakażeniu. Ten sam zespół w innym zestawie komórek świńskich zmodyfikował 20 genów, o których wiadomo było, że wywołują u człowieka odpowiedź immunologiczną, odrzucenie przeszczepu. To sprawa zasadniczej wagi, jeśli transplantowane narządy mają się przyjmować.
Church sklonował te komórki i hoduje je w zarodkach świńskich. Spodziewa się, że najwyżej za dwa lata będzie mógł zacząć testy na małpach jako biorcach. Jeśli narządy będą działały prawidłowo i nie zostaną odrzucone przez układ odpornościowy biorcy, następnym etapem będą badania kliniczne na ludziach. – Gdybyśmy mieli pod dostatkiem narządów, można by je dawać każdemu, kto tego potrzebuje – podkreśla naukowiec.
Tchórz czarnołapy należy do najbardziej zagrożonych wyginięciem ssaków Ameryki Północnej. Kiedyś był pospolity na Wielkich Równinach. Wszystkie żyjące dziś osobniki tego gatunku są potomstwem w kolejnych pokoleniach siedmiu zwierząt odkrytych w 1981 r. na farmie hodowlanej w pobliżu Meeteetse w stanie Wyoming. I z tego właśnie powodu współczesnym tchórzom brak różnorodności genetycznej, a to znacznie zmniejsza szansę na przetrwanie gatunku.
– Tchórz czarnołapy to klasyczny przykład gatunku, który może zostać ocalony za pomocą metod genomowych – tłumaczy Ryan Phelan z organizacji Revive & Restore, która zajmuje się koordynowaniem działań na rzecz ochrony tchórzy. Phelan wraz z Oliverem Ryderem z San Diego Frozen Zoo (instytut utrzymujący bazę zamrożonych komórek i zarodków różnych narażonych na wyginięcie gatunków zwierząt) podjęli próbę zwiększenia różnorodności genetycznej populacji tchórza, wprowadzając do ich genomów warianty DNA pobrane od bezpotomnych osobników, których komórki zamrożono 30 lat temu.
Praca Phelana ma rozwiązać dwa powiązane ze sobą zagrożenia dla gatunku. Pierwszym jest brak pokarmu: głównym pożywieniem tchórzy są bowiem pieski preriowe (nieświszczuki czarnoogonowe), których populacje zostały zdziesiątkowane przez zarazę wywołaną pałeczką dżumy, tą samą, która powodowała wielkie epidemie u człowieka. Śmiertelnemu zakażeniu ulegają też tchórze, jeśli zjadają padłe od choroby nieświszczuki. Dla ludzi szczepionka przeciw dżumie została opracowana w latach 90. XX w.; zaszczepione nią tchórze uzyskują trwałą odporność na zakażenie. Kevin Esvelt, który pracował z Churchem nad metodami CRISP i napędu genowego, zaproponował jednak coś bardziej wyrafinowanego.
– Jeśli chce się nadać odporność na jakąś chorobę – wyjaśnia – trzeba tylko zakodować przeciwciała, które wytwarzają się po szczepieniu, i wpisać je w materiał genetyczny tchórzy.
Esvelt jest przekonany, że dzięki tego rodzaju działaniom nie tylko uda się nadać tchórzom odporność na zarazę, lecz także wykorzenić boreliozę, chorobę wywoływaną przez bakterie przenoszone przez kleszcze, które zazwyczaj pasożytują na myszakach (Peromyscus leucopus).
Gdyby udało się za pomocą CRISP zmodyfikować myszakom DNA tak, aby uzyskały odporność na boreliozę, i rozpowszechnić tę cechę w naturalnej populacji, można by tę chorobę wyeliminować lub znacznie ograniczyć, nie uciekając się do metod o negatywnych skutkach ekologicznych. Esvelt i Church mają jednak świadomość, że takich eksperymentów nie wolno podejmować bez szerokich konsultacji społecznych i uzyskania poparcia opinii publicznej, a także bez uprzedniego opracowania metod ewentualnego odwrócenia skutków tych działań, czyli bez opracowania jakiegoś antidotum. Gdyby się okazało, że zredagowane DNA wywołuje nieprzewidziane skutki, można by zastosować to antidotum i wyeliminować modyfikacje z populacji.
Tchórz czarnołapy to nie jedyny gatunek, który można uratować za pomocą CRISPR i napędu genowego. Awifauna Hawajów wymiera w zastraszającym tempie, głównie wskutek ptasiej zimnicy. Zanim w XIX w. wielorybnicy na swoich statkach zawlekli na Hawaje komary, ptaki archipelagu nie stykały się z przenoszonymi przez te owady chorobami, a więc nie były na nie odporne. Do dziś ocalały zaledwie 42 spośród ponad setki endemicznych dla tych wysp gatunków ptaków, a trzy czwarte z nich jest już na liście zagrożonych wyginięciem. Ptasia zimnica nie jest jedynym niebezpieczeństwem czyhającym na rodzime ptaki Hawajów, ale jeśli się tej choroby nie powstrzyma – a metoda redagowania genów wydaje się najlepszą drogą do osiągnięcia tego celu – to prawdopodobnie wszystkie wyginą.
Jack Newman był szefem do spraw naukowych firmy farmaceutycznej Amyris, która opracowała syntetyczną artemizynę – jedyny naprawdę skuteczny lek przeciwmalaryczny dla ludzi. Dziś Newman skoncentrował się na walce z chorobami ptaków przenoszonymi przez komary. Obecnie jedyną metodą ochrony ptaków przed malarią jest tępienie komarów za pomocą wielkoobszarowych oprysków silnymi insektycydami.
A wiele owadów żyje i rozmnaża się w dziuplach drzew czy szparach skalnych. Gdyby chcieć do nich dotrzeć z chemikaliami, trzeba by wytruć większość naturalnej fauny wilgotnych lasów równikowych na Hawajach. Gdyby natomiast posłużyć się manipulacją genetyczną, dzięki której komary stałyby się bezpłodne, można by pomóc ptakom bez niszczenia ich środowiska.
– Używając do ratowania tych gatunków inżynierii genetycznej, możemy problemy środowiskowe rozwiązywać z niezwykłą precyzją – podkreśla Newman. – Ptasia malaria rujnuje przyrodę Hawajów, a my rozporządzamy metodą pozwalającą powstrzymać tę klęskę. Mamy siedzieć z założonymi rękami?
Niemniej jednak głupotą byłoby nie dostrzegać, że istnieje możliwość wyrządzenia za pomocą tych nowych narzędzi szkód (w tym przede wszystkim szkód mimowolnych, które ujawnią się po jakimś czasie). Naukowcy odpowiedzialni za rozwój takich metod jak CRISPR są zgodni, że gdy zacznie się majstrować przy dziedzictwie genetycznym jakiegoś gatunku, zwłaszcza człowieka, to jeśli coś pójdzie nie tak, niełatwo będzie cofnąć skutki takiego majstrowania, a może nawet okaże się to niemożliwe.
– Jakie mogą być niezamierzone konsekwencje manipulacji genetycznych? – zastanawia się Jennifer Doudna, z którą rozmawiam na Uniwersytecie Kalifornijskim w Berkeley, gdzie wykłada chemię i biologię molekularną. W 2012 r. profesor Doudna i jej koleżanka z Francji, Emmanuelle Charpentier, jako pierwsze wykazały, że da się wykorzystać CRISPR do manipulacji na oczyszczonym DNA in vitro. – Nie wiem, czy mamy dość wiedzy o genomie człowieka, czy jakimkolwiek innym genomie, żeby odpowiedzieć na to pytanie. Ale ludzie będą korzystać z tych metod niezależnie od tego, czy wiemy wystarczająco dużo, czy nie.
Im szybciej nauka idzie naprzód, tym więcej budzi niepokojów. Tak było zawsze. Genetyczne „majsterkowanie” jest już rzeczywistością; wkrótce prawie na pewno możliwe staną się eksperymenty z zestawami CRISPR w warunkach niemal domowych. Perspektywa amatorów mających dostęp do narzędzi, które mogą zmienić podstawowe cechy dziedziczne roślin i zwierząt, może budzić obawy.
Ale korzyści, jakie te narzędzia dają, są ogromne. I nie wolno udawać, że tych narzędzi nie ma. Komary przenoszące malarię wywołują rok w rok ogrom cierpień, wykorzenienie tej i innych chorób przez nie przenoszonych wpisałoby się do księgi największych osiągnięć medycyny. Wprawdzie jest jeszcze stanowczo za wcześnie, żeby myśleć o korzystaniu z CRISPR do manipulacji w ludzkich zdolnych do przeżycia zarodkach, są jednak mniej kontrowersyjne metody ingerowania w ludzkie geny w taki sposób, by leczyć choroby dziedziczne bez zmieniania genetycznego dziedzictwa naszego gatunku.
Dzieci dotknięte chorobą Taya-Sachsa cierpią na uwarunkowany genetycznie niedobór ważnego enzymu, niezbędnego do metabolizowania odpadowych substancji tłuszczowych występujących w mózgu. Choroba jest rzadka i ujawnia się tylko wtedy, gdy dziecko odziedziczy wadliwe wersje genu od obojga rodziców. Za pomocą CRISPR bardzo łatwo można dokonać manipulacji w komórkach rozrodczych jednego z rodziców (powiedzmy w plemnikach ojca), czego skutkiem byłoby to, że dziecko nie otrzyma dwóch kopii wadliwego genu. Nie ma wątpliwości, że taka interwencja byłaby ratunkiem dla dziecka, a równocześnie zmniejszałaby szanse nawracania choroby w następnych pokoleniach. Podobny efekt można osiągnąć już dzisiaj dzięki zapłodnieniu pozaustrojowemu: implantacja zarodka wolnego od wadliwych genów zapewnia, że dziecko nie przekaże schorzeń dziedzicznych następnym pokoleniom.
Gdy stajemy w obliczu ryzyka, którego prawdopodobieństwo trudno ocenić, mamy silną skłonność do rezygnacji z działania. Ale musimy pamiętać, że stawką są miliony istnień ludzkich – w takiej sytuacji zaniechania nie wolno nam uznać za jedyny możliwy wybór.
Naukowcy z całego świata spotykają się na konferencjach, żeby dyskutować o etycznych aspektach takich wyborów, ale odpowiedzi nigdy nie będą łatwe. Jedno jest pewne: bez uchwalenia jasnych przepisów – a w chwili obecnej nie ma żadnych regulacji dotyczących redagowania DNA metodą CRISPR i podobnymi – ogromne możliwości, jakie może przynieść rewolucja, będą przesłaniane przez obawy.
– Napęd genowy i CRISPR dają nam teraz taką władzę nad wszelkimi gatunkami, o jakiej nam się nigdy nie śniło – mówi Hank Greely, dyrektor stanfordzkiego ośrodka zajmującego się aspektami prawnymi nauk biologicznych. – Dzięki temu możemy wyświadczyć światu niewiarygodnie dużo dobrego. Ale powinniśmy też zdawać sobie sprawę z tego, że mamy do czynienia z możliwościami zupełnie nowymi, różnymi od tego, co znaliśmy. Musimy zatem wymyślić jakiś sposób, żeby korzystać z tych możliwości mądrze, wyłącznie mądrze. Dziś jeszcze tego sposobu nie znamy, a czas nas goni.
Tekst: Michael Specter
Zdjęcia: Greg Girard